|
近年来,随着对肠道菌群研究的不断深入,学界和普通大众对于其作为宿主“第二基因组”在宿主健康中发挥的极端重要性也有了较为充分的了解。然而,肠道菌群还有相对鲜为大众所熟知的另一方面:从肠道逃逸的菌群可能会有极端危险性。在正常情况下(也就是在健康人体中),肠道菌群会受到肠粘膜屏障的严密控制,同时免疫系统也严正以待,此时它们各司其职,表现得忠诚友善。然而,一旦受到宿主内外环境的影响,尤其是免疫系统出现漏洞或受到类似HIV/SIV病原体攻击时,肠粘膜屏障极易出现损伤,此时肠道菌群很可能会逃离“兵营”。其后果正像从战场上逃逸的士兵一样,当中的一些或许会掉转枪头,对“老东家”下手。
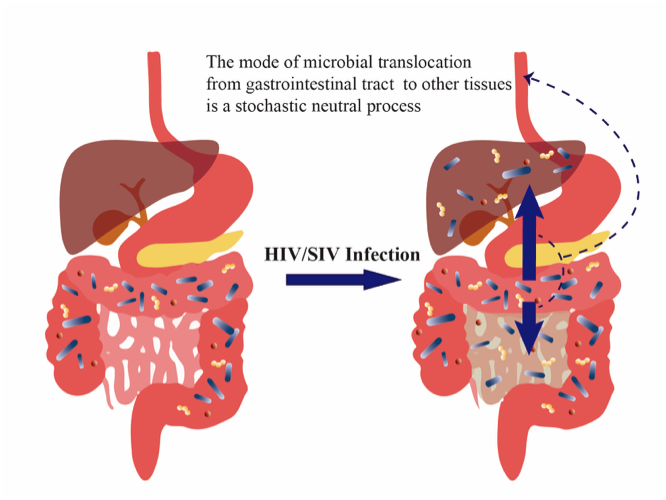
中科院昆明动物研究所马占山学科组博士生李文迪最新一项研究试图回答如下问题:(1)受HIV/SIV病毒感染后,肠道菌群中微生物逃逸(学术名词是“菌群易位”or microbial transloation) 是有计划、有组织的逃逸,还是近乎无序的随机游离?(2)可否从理论上估计出迁移概率以及迁移比例。该研究近日在线发表于欧洲微生物学会旗下的FEMS Microbiology Ecology。研究通过理论建模分析,首次对以上问题作出了较为合理的回答。
当宿主感染了SIV/HIV后,胃肠道黏膜中的CD4+ T细胞会迅速衰减,黏膜免疫被过度激活,持续性的炎症反应诱发上皮细胞凋亡和紧密连接中断,从而使得黏膜上皮完整性被破坏(“肠漏”);与此同时,肠道内环境紊乱也致使其内部栖息的菌群失调,益生菌数量骤减,机会性病原菌逐渐占据主导地位。这一系列的免疫病理过程最终导致胃肠道内微生物发生逃逸。
李文迪通过分析SIV感染的猕猴的多组织(包括肠道、肠系膜淋巴结和肝脏)菌群数据,该项研究发现微生物从胃肠道逃逸到其他组织的过程类似于物理学中的随机游动 (random walk)。也就是说,虽然肠道微生物逃逸很可能是由于SIV感染导致的,但逃逸的过程是随机的、并非有组织地确定性迁移。此外,该研究还发现菌群从胃肠道逃逸至肠系膜淋巴结或肝脏的概率(即迁移率,在属水平均>0.5)显著高于菌群在胃肠道内部的扩散率(在属水平=0.01),并且胃肠道菌群中有接近23%的菌门和55%的菌属可能会从胃肠道逃逸至肠系膜淋巴结和肝脏。
微生物易位与SIV/HIV感染过程中机体出现的慢性炎症密切相关。此外,易位到其他组织的微生物很可能会触发自身免疫,从而增加了病毒感染者患退行性疾病的风险。该研究在揭示微生物易位模式的同时,也加深了目前对组织菌群的认识。直到不久前,许多组织还被认为是完全无菌的环境。然而,最近的研究却逐渐改变了对这一观点的认知。除胃肠道外,肺、乳腺组织、健康的胎盘、肝胆系统、前列腺甚至血液中都发现了微生物菌群的存在,其中一些菌群可能是自身携带的正常菌群,有些则可能是通过微生物易位或外界感染所形成的。对组织菌群的研究虽然起步较晚,但其重要性不言而喻。特别是在肿瘤的相关研究中,越来越多的证据表明微生物通过代谢和与宿主细胞的相互作用参与塑造了调节肿瘤发生的微环境(tumor microenvironment)。该研究利用理论模型,初步解读了组织微生物菌群的形成和维系的潜在生态学机制,为日后相关领域的研究提供了一定的理论基础。
论文来源:Wendy Li & Zhanshan (Sam) Ma (2020) A theoretic approach to the mode of gut microbiome translocation in SIV-infected Asian macaques. FEMS Microbiology Ecology, https://doi.org/10.1093/femsec/fiaa134。该杂志系目前是微生物生态学领域较为公认的三大重要期刊之一(其余两个分别为 Nature 子刊 “The ISME Journal”,以及“Microbial Ecology”)。
第一作者李文迪2016年本科毕业于南方医科大学,后推免进入昆明动物所硕博连读,目前以一作身份发表SCI论文3篇,预计2020年将有5篇SCI一作论文发表(其中2篇已见刊,另外3篇处于修改或审稿阶段)。 此外已合作完成了“Primer of Ecological Statistics” 一书翻译,预计将由高教出版社以精品外国教材推介出版。受新冠肺炎COVID-19疫情“影响”,博士论文研究方向改攻“新冠肺炎COVID-19 进化医学生态学”。
| 




