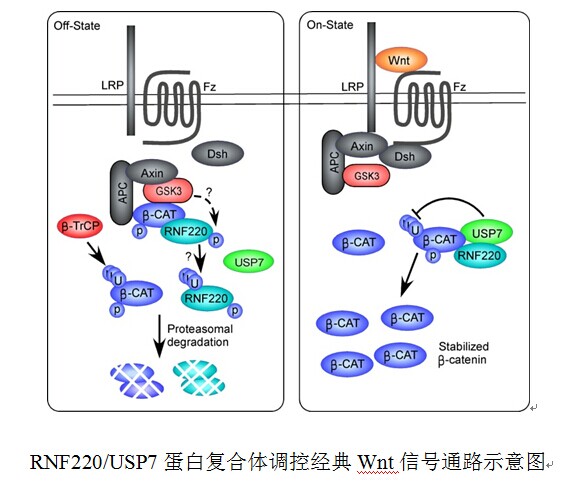
Wnt信号通路普遍存在于多细胞真核生物中,与早期胚胎发育和肿瘤的发生等密切相关。经典Wnt信号通路的激活最终是通过其下游效应因子β-catenin的入核而启动其靶基因表达的,对β-catenin稳定性的调节是调控Wnt信号活性的重要途径之一。
RNF220是毛炳宇课题组鉴定的一个泛素连接酶。在本研究中,马鹏程博士等发现RNF220可与β-catenin结合。然而, RNF220不会促进β-catenin的泛素化与降解,反而会引起其去泛素化而提高其稳定性。进一步的研究发现,这一过程是由一个与RNF220相互作用的去泛素化酶USP7介导的。RNF220对β-catenin的调节依赖于USP7,USP7通过与RNF220的相互作用被招募到USP7/RNF220/β-catenin蛋白复合体中,进而通过去泛素化β-catenin提高其稳定性,增强Wnt信号活性。有意思的是,RNF220蛋白的稳定性受到Wnt信号活性的正调节,因而RNF220/USP7复合体可作为经典Wnt信号的正反馈调节因子进一步增强Wnt信号活性。在结肠癌细胞系HCT116和SW480中,通过RNAi敲低RNF220或USP7的表达,均可显著降低细胞中的Wnt信号活性和Wnt信号靶基因的表达,表明RNF220/USP7介导的Wnt信号调节可能在肿瘤发生中具有一定贡献。
该研究成果进一步丰富了对蛋白质泛素化修饰和Wnt信号调控机制的认识,已于近日在线发表于《分子与细胞生物学》(Molecular and Cellular Biology)杂志。文章链接:http://mcb.asm.org/content/early/2014/09/23/MCB.00731-14.long。该研究得到了国家自然科学基金和中科院西部之光项目的经费支持。