去甲肾上腺素是外周系统一类常见且非常重要的神经递质,可引起小血管收缩和血压增加。在中枢神经系统(脑)中,也存在一群特异性以去甲肾上腺素为神经递质的神经元;这些神经元主要分布于脑干的蓝斑核(Locus Coeruleus)中,它们的轴突投射至整个脑中,调控各个脑区神经元的活性。众多证据表明,中枢去甲肾上腺素系统和精神类疾病(如认知障碍、焦虑和抑郁)以及神经退行性疾病(帕金森症和阿兹海默症)紧密相关。蓝斑核的去甲肾上腺素能神经元产生于胚胎发育E10.5天的第一菱脑原节(rhombomere 1),并于胚胎发育后期迁移到脑桥。现已发现很多信号分子通路,如FGF8、BMP、Wnt和Notch,对这群神经元祖细胞的特化起到重要作用。另外,一些转录因子(如Phox2a和Phox2b)也对去甲肾上腺素能神经元的分化和维持起关键作用。Phox2a和Phox2b直接调控去甲肾上腺素生物合成的关键酶(酪氨酸羟化酶TH和多巴胺-β-羟化酶DBH)的表达, Phox2a或者Phox2b的基因敲除都会造成去甲肾上腺素能神经元缺失。
RNF220/ZC4H2是毛炳宇课题组鉴定出来的一个特异在脊椎动物发育中的神经系统中表达的泛素连接酶复合体。由该组牵头的合作研究结果表明,RNF220/ZC4H2泛素连接酶复合体通过促进Gli转录因子的K63类型的多泛素化修饰调控其出入核转运,参与Sonic hedgehog (Shh) 信号通路的调控,参与脊椎动物腹侧神经管的图式形成过程(Ma et.al., 2019, Cell Rep; Ma et.al., 2019, J Mol Cell Biol)。在此基础上,该组和复旦大学的丁玉强教授课题组继续深入合作研究发现,RNF220/ZC4H2都在蓝斑核发育中的去甲肾上腺素能神经元中特异高表达;在RNF220和ZC4H2敲除的小鼠中,蓝斑核处的去甲肾上腺素能神经元均不能正常分化发育。进一步体内和体外生化实验表明,RNF220/ZC4H2泛素连接酶复合体促进转录因子Phox2a/2b的单泛素化修饰,增强其转录活性。最后,作者通过鸡胚电转的实验在体内证明了RNF220/ZC4H2泛素连接酶复合体介导的Phox2a/2b的单泛素化修饰对其下游靶基因TH和DBH的转录调控活性。
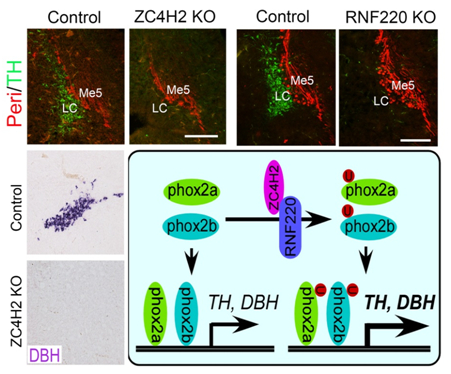
图示RNF220/ZC4H2泛素连接酶复合体通过单泛素化修饰转录因子Phox2a/2b参与中枢去甲肾上腺素能神经元发育的机制。
该研究揭示了蓝斑去甲肾上腺素能神经元发育调控的一种新的分子机制,阐明了非经典的单泛素化修饰调控Phox2a和Phox2b蛋白转录活性的新的分子机制以及泛素连接酶复合体RNF220/ ZC4H2在神经系统发育中的又一重要功能。近日,该研究以“RNF220/ZC4H2-mediated monoubiquitination of Phox2 is required for noradrenergic neuron development ”为题发表在《Development》杂志上(文章链接:https://dev.biologists.org/content/early/2020/02/13/dev.185199)。复旦大学宋宁宁副研究员、昆明动物所马鹏程副研究员和复旦大学章琼博士为文章的共同第一作者,毛炳宇研究员和复旦大学丁玉强教授为文章的共同通讯作者。





