中科院大连化学物理研究所秦建华研究员团队与中科院昆明动物研究所郑永唐研究员团队合作,利用器官芯片技术建立了一种体外肺器官微生理系统,模拟了新冠病毒感染人体导致的肺组织损伤和免疫反应等,为新冠病毒致病机制研究和快速药物评价等提供了新策略和新技术。
新型冠状病毒(SARS-CoV-2)感染已导致全球大流行,新冠肺炎确诊病例仍在持续增长,严重威胁人类健康。肺脏是SARS-CoV-2感染的主要靶器官。新冠肺炎临床表现轻重不一,主要有发热、乏力、干咳等,重症患者还可累及多个脏器,出现多器官功能衰竭。有研究显示,人体免疫系统过度反应触发的“炎症因子风暴”是导致患者从轻症向重症转化的主要诱因之一。目前新冠肺炎的临床治疗多以综合治疗为主,但仍缺乏特效药物。尽管前期已有细胞和动物模型用于新冠病毒研究,但在一定程度上仍存在诸多局限。现阶段,仍缺少能够在组织器官水平反映人体对新冠病毒感染响应的研究模型,这也是严重制约当前新冠病毒药物研发进程的瓶颈之一。
器官芯片是一种新兴前沿交叉科学技术,它融合了物理、化学、工程学和生物学等多学科方法,可在几平方厘米大小的流控芯片上仿生构建多种人体组织器官的微缩模型,用来反映人体器官的关键结构与生物功能。特别是,它有可能以前所未有的方式在体外再现人体对多种外界因素刺激的响应,在生命科学研究、疾病研究和新药研发等领域具有广泛应用潜力。
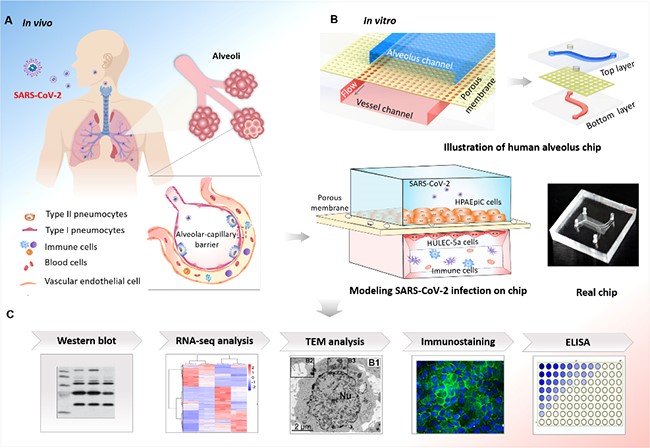
肺泡是人体肺脏的基本功能单位,其中肺泡—毛细血管屏障对于维持肺脏气体交换和抵御外界病原体感染至关重要。本工作中,研究者首先利用器官芯片技术仿生构建了人体肺泡功能单元,并进一步开展新冠病毒感染实验。研究者从人体肺组织复杂结构与功能特点出发,在具有多层分腔设计的可灌注微芯片中模拟人体肺泡组织微环境;实验中,在芯片多孔膜两侧(肺泡侧/血管侧)的微腔内,通过人肺泡上皮细胞、肺微血管内皮细胞和人外周血免疫细胞的动态共培养,建立了包含多种人源细胞、机械流体和组织界面等复杂因素的功能性肺泡-毛细血管屏障,然后开展芯片上的新冠病毒感染实验。
结果显示,当芯片上肺泡侧上皮细胞暴露于新冠病毒后,上皮细胞内可见大量病毒复制,并出现肺组织屏障完整性破坏。转录组分析发现,SARS-CoV-2感染在两种细胞中触发不同的响应机制,分别激活了上皮细胞中I型干扰素通路和内皮细胞中JAK-STAT通路等。根据病毒载量计算,人肺泡上皮细胞呈现更强的病毒易感性,是病毒复制的主要场所,而人肺微血管内皮细胞中病毒载量较低,提示病毒可能通过感染肺上皮细胞间接影响内皮细胞。此外,研究发现,病毒感染还可导致芯片血管侧人外周血免疫细胞在血管内皮细胞上的粘附增加,并释放大量炎症因子(如IL-1β,IL-6,IL-8,TNF-α),提示新冠病毒感染肺组织可能通过激活人体免疫细胞释放大量炎症因子,诱发肺微血管内皮损伤。利用该模型,研究者还对抗病毒化合物的药效进行了初步测试和评价。
本研究利用器官芯片技术,建立了基于组织水平的人类新冠肺炎疾病模型,在体外模拟了新冠病毒感染导致的肺屏障功能障碍、免疫细胞粘附、炎症因子释放和肺内皮细胞损伤等一系列关键病理生理过程,反映了新冠病毒感染中多细胞复杂因素参与介导的病原—宿主相互作用。这种模型系统具有建模周期短、成本低、人源性和易于监测等特点,可以得到传统方法难以获取的动态生物学信息,并可延伸用于多器官累及的新冠肺炎机理研究。
该工作于近日发表于《先进科学》(Advanced Science, DOI: 10.1002/advs.202002928)上。中科院大连化学物理研究所张敏副研究员、王鹏博士、王亚清博士和中科院昆明动物所罗荣华实验师为共同第一作者;中科院昆明动物所郑永唐研究员和中科院大连化学物理所秦建华研究员为共同通讯作者。