

蛋白质的定点修饰是通过化学反应对蛋白质特定位点进行修饰,从而达到对蛋白质改性或对其进行标记等一系列目的。蛋白质的定点修饰对反应条件严格:反应需要在水相溶液中进行,同时蛋白质其它侧链基团不参与反应。近日,上海交通大学王平特别研究员课题组与中国科学院昆明动物研究所郑永唐研究员课题组合作,发展了一种由仿生的邻醌介导对蛋白N-端进行选择性修饰的方法,并成功将其运用于蛋白质标记和抗HIV药物研发等领域。
蛋白质的N-端-α胺基相较于赖氨酸的ε胺基有较低的pKa,因而更具有亲核性,是蛋白质定点修饰的理想位点。在自然界中,铜胺氧化酶催化酪氨酸的侧链酚基被氧化成邻醌,邻醌可将体系内的一级胺氧化成醛,酮基。受此启发,作者发展了蛋白质仿生转氨化的方法。作者通过筛选多种邻醌类化合物与模板肽进行反应,发现邻醌试剂在pH 6.5 的缓冲水溶液中具有最高的活性,能在2小时内将N-端为甘氨酸的模板肽8转换为醛,随后与乙氧基胺作用产生更稳定的肟产物9,两步总转换率达到91%,而模板肽中的赖氨酸ε胺基在该反应条件下产生的副反应低于1%。该氧化条件适用于N-端为精氨酸、亮氨酸,赖氨酸,甲硫氨酸、谷氨酸,天门冬氨酸、丝氨酸、苏氨酸、色氨酸和天门冬酰胺等多肽的修饰,均能以高产率获得修饰多肽。
随后,该方法被应用于蛋白质目标物泛素及肌红蛋白的修饰,均能以70%以上的转化率得到目标肟产物及生物素标记的肌红蛋白修饰产物。由于反应条件对蛋白序列中游离的半胱氨酸巯基并不耐受,作者进而发展了光敏保护基策略,即先将蛋白质中游离的半胱氨酸与小分子2-硝基胡椒苄溴反应而被选择性保护,随后进行转胺化反应,最后通过光解脱除保护基,即得到目标修饰蛋白质。整个反应过程中不需额外分离手段,只需通过简单萃取去除小分子反应物即可,从而最大限度地维持了蛋白质的三级结构。作者将该策略成功应用于含游离半胱氨酸的SUMO2和RNF4蛋白质的转胺化。
蛋白质趋化因子CCL4是HIV辅助受体CCR5的配体。作者利用该策略对CCL4的 N-端进行转胺化修饰,快速得到了一系列修饰蛋白质29-45。抗HIV-1活性体外实验表明,带修饰蛋白质30和31的抗HIV-1活性相较于表达的CCL4活性有显著提高。该实验表明,通过蛋白质化学合成与定点修饰联用可以在短时间内得到大量不同修饰的蛋白质,这在很大程度上为抗HIV蛋白质类药物的制备提供了技术手段。
该工作成果发表于权威期刊Nature Communications上(2021, 12:2257, DOI: 10.1038/s41467-021-22654-7)。上海交通大学王平特别研究员和中科院昆明动物所郑永唐研究员为该研究论文共同通讯作者,上海交通大学王嗣尧、周清清、陈小平和中科院昆明动物研究所罗荣华为共同第一作者。该研究工作获国家自然科学基金委和中国科学院个性化药物先导专项的资助。
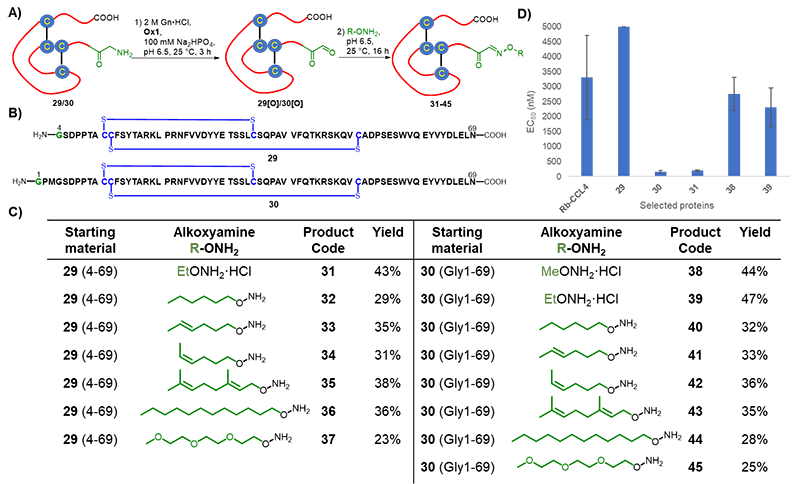
图. HIV辅助受体CCR5配体CCL4的N-端修饰及其抗HIV-1活性研究
