

阿尔茨海默病(Alzheimer’s disease,AD)是一种病因复杂的神经退行性疾病,社会负担沉重。研究表明,遗传因素在AD的发生发展过程中扮演着重要角色。近年来基于欧洲血统人群开展的全基因组关联分析(genome-wide association studies,GWAS),已经报道了大量与AD发病显著相关的风险基因及其风险变异。由于AD疾病的复杂性和不同人群遗传背景的差异性,基于我国AD人群的遗传学研究日渐受到关注。
前期,姚永刚团队在我国早发及家族性AD患者中,发现多个国人特异的与AD风险相关的稀有变异位点(Natl Sci Rev 2019)。进一步分析发现,溶酶体组织蛋白酶基因CTSH的稀有异义变异rs2289702在我国人群中展现出AD发病的保护效应,其效应在欧洲人群也得到验证,是不同人群共有的AD保护性变异。CTSH基因在AD病人脑组织中呈现高表达趋势。在AD小鼠模型中,该基因表达水平与Aβ斑块沉积、tau蛋白过度磷酸化水平正相关。对该变异开展的功能基因组学分析和细胞实验表明,rs2289702是一个调控性变异位点,能够影响转录因子ZPF69B与CTSH基因启动子区结合,从而下调CTSH基因表达。机制研究发现,敲除CTSH可以促进小胶质细胞吞噬Aβ42的能力。这些结果提示,由rs2289702变异导致的CTSH低水平表达是该变异对于AD发病具有保护性效应的一个原因;干预CTSH表达水平,是有望缓解AD发生的一种方式(Neuropsychopharmacology 2023)。
在另一项研究中,团队对我国散发性AD患者群体开展了目标基因靶向捕获测序,集中针对细胞因子、趋化因子等免疫通路基因开展了分析。发现EGF基因在AD患者中富集功能丢失的变异(loss-of-function,LoF),且该基因的常见变异rs4698800与AD遗传风险相关。rs4698800变异可通过上调EGF基因表达水平,从而增加我国散发性AD人群的发病风险。值得注意的是,最新的欧洲人群大规模GWAS研究发现,下调该基因的受体EGFR表达水平的遗传变异,在欧洲人群中展现出AD发病的保护作用(Bellenguez et al. 2022)。这些结果共同提示,EGF-EGFR通路在AD发生发展过程中扮演重要的角色,有望作为干预AD的潜在靶点(Neurobiology of Aging 2023)。
与细胞因子EGF遗传变异和AD相关的研究结果不同,团队没有在散发性AD人群中发现趋化因子遗传变异与AD风险相关。综合分析AD病人和小鼠模型研究数据发现,多个趋化因子的表达水平在AD患者和小鼠模型的脑组织中显著上调,且与AD小鼠的Aβ和tau蛋白病理水平显著相关。其中,外周血中CXCL16基因的mRNA表达水平随着AD严重程度加重而升高,提示CXCL16可作为AD发生发展的潜在生物标志物。孟德尔随机化分析则发现,CCL5的蛋白表达异常可能驱动了AD发病。这些结果表明,虽然团队没有在研究的散发性AD人群中观察到趋化因子遗传变异与AD发病风险相关,但若干趋化因子的表达调控异常,很可能参与了AD的发生发展过程。CXCL16表达变化作为AD的潜在生物标志物值得进一步研究和临床验证(Alzheimer’s Research & Therapy 2023)。
这些系列进展发表论文的主要作者包括博士研究生李余和李晓、副研究员毕蕊和徐敏,以及张登峰研究员和姚永刚研究员。上述研究工作得到科技部、国家自然科学基金委、中国科学院和云南省等的资助。
系列进展论文:
Li Y, Xu M, Xiang BL, Li X, Zhang DF, Zhao H, Bi R, Yao YG. Functional genomics identify causal variant underlying the protective CTSH locus for Alzheimer's disease. Neuropsychopharmacology, 2023, doi: 10.1038/s41386-023-01542-2; https://www.nature.com/articles/s41386-023-01542-2
Li X, Xu M, Bi R, Tan LW, Yao YG, Zhang DF. Common and rare variants of EGF increase the genetic risk of Alzheimer's disease as revealed by targeted sequencing of growth factors in Han Chinese. Neurobiol Aging, 2023, 123: 170-181; https://www.sciencedirect.com/science/article/pii/S0197458022002238?via%3Dihub
Li X, Zhang DF, Bi R, Tan LW, Chen X, Xu M, Yao YG. Convergent transcriptomic and genomic evidence supporting a dysregulation of CXCL16 and CCL5 in Alzheimer's disease. Alzheimers Res Ther, 2023, 15(1): 17; https://alzres.biomedcentral.com/articles/10.1186/s13195-022-01159-5
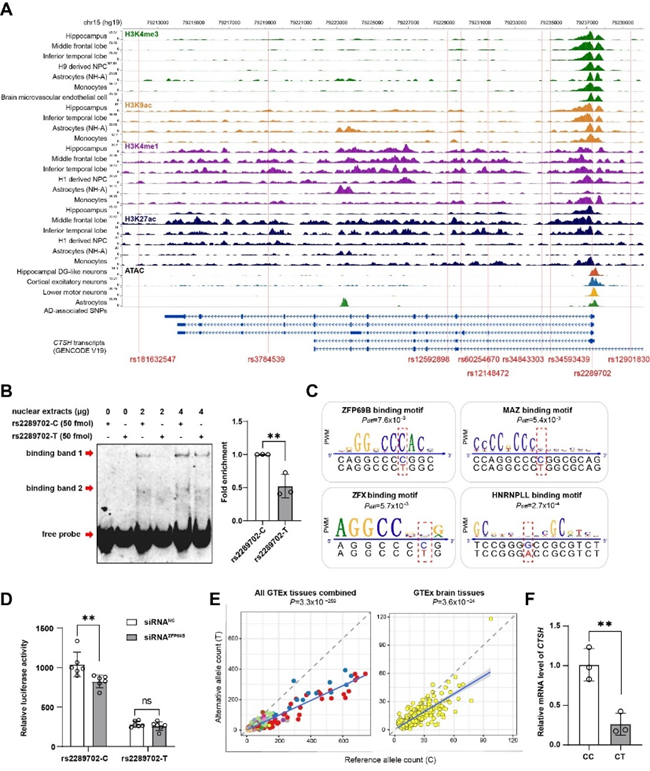
图1 rs2289702变异下调CTSH基因表达
