2024年1月24日,中国科学院昆明动物研究所、昆明医科大学陈策实课题组在《Cell Death & Disease》杂志在线发表了题为“HECTD3 inhibits NLRP3 inflammasome assembly and activation by blocking NLRP3-NEK7 interaction”的研究论文。该研究发现,E3泛素连接酶HECTD3能够通过抑制NLRP3与NEK7的结合从而以非酶活依赖方式抑制NLRP3炎症小体的组装与活化,该研究为NLRP3相关的炎症性疾病治疗提供了潜在的新靶点。
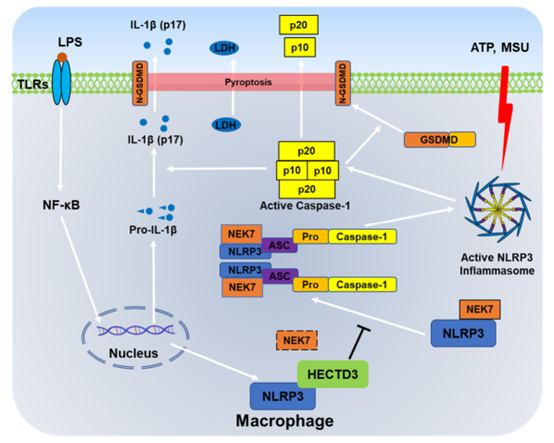
NLRP3是一种细胞内模式识别受体。NLRP3在感知内源和外源性的各种刺激后,其能够通过招募NEK7、ASC及pro-Caspase-1等蛋白从而组装成能够介导pro-Caspase-1酶原激活的复合物,该复合物即被称之为NLRP3炎症小体。炎症小体组装能够促进Caspase-1的切割与活化,活化后的Caspase-1一方面能够介导促炎细胞因子IL-1β和IL-18的切割与成熟,另一方面还能够促进GSDMD切割以促进细胞焦亡,这两个过程共同导致炎症反应的发生。NLRP3炎症小体的激活需要预激活信号与激活信号两个信号步骤。预激活是由TLRs、 NOD2和TNFR1/2等受体介导的NF-κB信号通路活化从而上调NLRP3和pro-IL-1β的转录及表达的过程;激活是由ATP、尿酸钠晶体、尼日利亚菌素等多种类型的内源或外源性物质介导NLRP3的构像改变从而促进NLRP3炎症小体的组装过程。由于NLRP3炎症小体的激活因子最为广泛,相关疾病类型众多,因此成为目前免疫学研究领域最为热门的靶点之一。
该研究发现E3泛素连接酶HECTD3能够抑制NLRP3炎症小体的激活过程而对于NLRP3炎症小体的预激活过程没有影响,并且HECTD3对于NLRP3炎症小体激活的影响不依赖其E3泛素连接酶活性;进一步地,他们发现HECTD3以非酶活依赖方式抑制了NLRP3-NEK7互作、NLRP3多聚化、NLRP3-ASC互作与ASC多聚化等NLRP3炎症小体组装的各个过程;机制研究表明,HECTD3能够通过DOC结构域与NLRP3的NACHT及LRR结构域相互作用,该互作能够阻断NLRP3对NEK7的招募,由此导致了NLRP3炎症小体组装过程的受阻。最后,他们通过向小鼠踝关节腔注射尿酸钠晶体构建了NLRP3炎症小体相关的痛风性关节炎模型,结果表明HECTD3能够抑制痛风性关节炎的炎症反应,并且NLRP3阻断剂MCC950能够挽救巨噬细胞HECTD3缺失所介导的炎症增加。综上,该研究认为巨噬细胞中的HECTD3能够通过抑制NLRP3与NEK7的结合从而以非酶活依赖方式抑制NLRP3炎症小体的组装与活化,该过程有助于改善小鼠痛风性关节炎的炎症水平。
陈策实研究员和昆明医科大学的李富兵副研究员为该论文的共同通讯作者,中国科学院昆明动物研究所的在读博士生程卓为该论文的第一作者。该工作得到了国家重点研发计划、国家自然科学基金、云南省生物医药科技重点计划等项目的资助。